新闻中心
开拓药业公布2022年中期业绩及近期业务亮点
开拓药业公布2022年中期业绩及近期业务亮点
【概要描述】北京时间2022年8月29日,开拓药业(股票代码:9939.HK),一家专注于潜在同类首创和同类最佳创新药物研发及产业化的生物制药公司,今日公布2022年中期业绩和近期业务亮点。
- 分类:公司新闻
- 作者:
- 来源:
- 发布时间:2022-08-29 23:10
- 访问量:
北京时间2022年8月29日,开拓药业(股票代码:9939.HK),一家专注于潜在同类首创和同类最佳创新药物研发及产业化的生物制药公司,今日公布2022年中期业绩和近期业务亮点。
开拓药业创始人、董事长兼首席执行官童友之博士表示:"2022年上半年,尽管市场环境挑战重重,公司在全球多中心注册性III期临床试验、生产和商业化准备等方面仍取得快速的进展。核心产品普克鲁胺作为对轻、中和重症新冠患者均有效的新冠口服药,已在多个国家取得紧急使用授权(EUA)。另一款核心产品福瑞他恩目前正在中国进行注册性III期临床试验和在美国进行II期临床试验,其治疗男性脱发中国II期临床试验积极数据由主要研究者在第六届全国毛发学术会议上正式公布。在资本市场方面,公司股票表现和交易流动性良好,并于今年5月获纳入MSCI中国指数。在荣誉奖项方面,普克鲁胺新冠项目陆续获得国家科技部以及江苏省科技厅等专项资金支持,此外公司还获得多项行业荣誉奖项。
自公司创立以来,开拓药业始终聚焦未被满足的临床需求,致力于创新疗法研究、开发及商业化。展望未来,公司将继续加快核心产品的全球临床试验进程,积极推进商业化工作,继续为股东创造长远价值。"
近期业务发展亮点
普克鲁胺对轻、中和重症新冠患者均有效
新冠疫情爆发后,公司核心产品普克鲁胺拓展推进新冠治疗的研究,发现其对新冠轻、中和重症患者均有很好的疗效。
2022年4月6日,公司公布了普克鲁胺治疗轻中症新冠患者III期全球多中心临床试验 (NCT04870606) 的关键数据结果。普克鲁胺可有效降低患者的住院/死亡率,特别是对于服药超过7天的全部患者,以及伴有高风险因素的中高年龄新冠患者达到100%保护率。普克鲁胺可显著持续降低新冠病毒载量,并改善新冠相关症状。普克鲁胺整体耐受性良好,安全可控,研究中未发现任何严重不良事件。
2022年5月,普克鲁胺在复旦大学附属中山医院老年医学中心进行由研究者发起的治疗重型或危重型新冠患者(服用Paxlovid后出现新冠复阳的患者)临床试验。研究显示,经过7至12天的治疗后实现病毒清除。我们将持续探索对重型或危重型,特别是服用Paxlovid后复阳的新冠患者的有效性、安全性研究。
此外,开拓药业研发团队于今年6月在bioRxiv在线发表研究论文,揭示普克鲁胺对重症新冠患者的作用机制。该论文表明,普克鲁胺可以发挥抗炎作用,降低急性肺损伤。
普克鲁胺不仅对轻中症新冠患者有效,也是重症新冠患者的有效治疗药物。2022年上半年,普克鲁胺已在多个国家和地区取得紧急使用授权(EUA)和授权使用,包括波斯尼亚和黑塞哥维那萨拉热窝州和加纳。
新冠疫情进入第三年,新冠病毒仍在继续发生变异,新冠肺炎防治在全球依然是严重的公共卫生难题。在这种情况下,有效、安全的口服新冠治疗药物对人类战胜新冠疫情十分重要。
福瑞他恩治疗男性脱发中国II期临床试验积极结果公布
根据第六届亚洲毛发移植大会发布的数据显示,全球脱发患者高达20亿,中国占据2.5亿,平均每6个中国人中就有1人存在脱发。脱发已然成为全球性的“难题”。福瑞他恩作为一款靶点明确的外用雄激素受体(AR)拮抗剂,已在中国治疗男性雄激素性脱发的II期临床试验中展示了良好的疗效和安全性。
2022年8月27日,该II期临床试验的主要研究者之一、北京大学人民医院张建中教授在由中华医学会皮肤性病学分会主办的第六届全国毛发学术会议上正式发布福瑞他恩治疗的积极数据。
临床试验共纳入120名符合Hamilton-Norwood分级(IIIv、IV、V级)的中国成年男性雄激素性脱发受试者,平均年龄35.6岁,按照1:1:1:1的比例随机分配至福瑞他恩2.5 mg(0.25%浓度)每日两次(BID)组、5 mg(0.5%浓度)每日一次(QD)组、5 mg(0.5%浓度)BID组和安慰剂组(QD组和BID组)。临床试验的主要终点为目标区域内非毳毛数量变化(治疗24周与基线的平均变化)。
结果显示,在福瑞他恩5 mg(0.5%浓度)BID组,目标区域头发数量(TAHC)治疗24周较基线显著增加22.73根/cm2(P<0.001),较安慰剂组显著增加15.34根/cm2(P= 0.024)。福瑞他恩5 mg BID为Ⅲ期临床试验的推荐给药剂量。福瑞他恩各剂量组的总体安全性良好,未发生严重不良事件(SAE)、严重药物不良反应(ADR)及死亡。局部外用14天后,体内福瑞他恩及其代谢产物的系统暴露量达到稳态,各剂量组经皮入血的药物浓度较低。
目前,公司正在加速推进福瑞他恩治疗男性雄激素性脱发的中国III期临床试验和美国II期临床试验,以及针对女性雄激素性脱发的中国II期临床试验。此外,福瑞他恩治疗痤疮的中国II期临床试验已于2022年1月24日完成首例患者入组给药。
雄激素性脱发和痤疮这两个适应症都有巨大的未被满足的临床需求。开拓药业作为首家研发外用PROTAC药物GT20029并全球首个进入临床阶段的公司,目前正在中美两国开展GT20029治疗雄激素性脱发和痤疮的I期临床试验,并分别于2022年2月1日完成美国I期临床试验首例受试者入组给药,以及于2022年8月9日完成中国I期临床试验所有92名受试者入组给药,预计该试验将于2022年第四季度完成锁库并进行数据分析。
临床前研究显示,GT20029通过降解AR蛋白可以有效阻断AR的信号通路和其生理功能,在局部产生疗效的同时,可以通过限制皮肤渗透达到减少全身药物暴露以获得更好的安全性。
公司将加速推进福瑞他恩和GT20029的临床进程,为全球数亿雄激素性脱发和痤疮群体带来更多创新有效的治疗选择。
推进多元化产品管线
开拓药业前瞻性布局了包含小分子创新药、生物创新药及联合疗法的多元化产品管线,目前拥有7款潜在First-in-Class或Best-in-Class的新药项目正在中国和全球开展临床I-III期研究。
开拓药业自2018年于辉瑞取得ALK-1单抗(GT90001)在全球范围内针对所有瘤种的独家开发注册、生产和商业化权利,由此开始了在生物药物领域的布局。GT90001作为全球潜在first-in-class创新药物,有望用于多种实体肿瘤的治疗。2022年5月2日, GT90001联合PD-1抗体Nivolumab二线治疗晚期肝细胞癌(HCC)美国II期临床试验已完成首例患者入组给药。
据此前在2021 ASCO GI大会上公布的GT90001联合Nivolumab的中国台湾II期临床结果显示:在20例可评估的患者中,有8例患者观察到部分缓解(PR),客观缓解率达到40%,且安全性良好。
2022年5月,GT90001联合Nivolumab治疗晚期肝癌II期全球多中心临床试验在美国完成首例患者给药。2022年7月,GT90001联合Nivolumab的中国台湾II期临床试验完成最后一例患者的末次访视。目前已经完成锁库,正在进行数据分析工作。
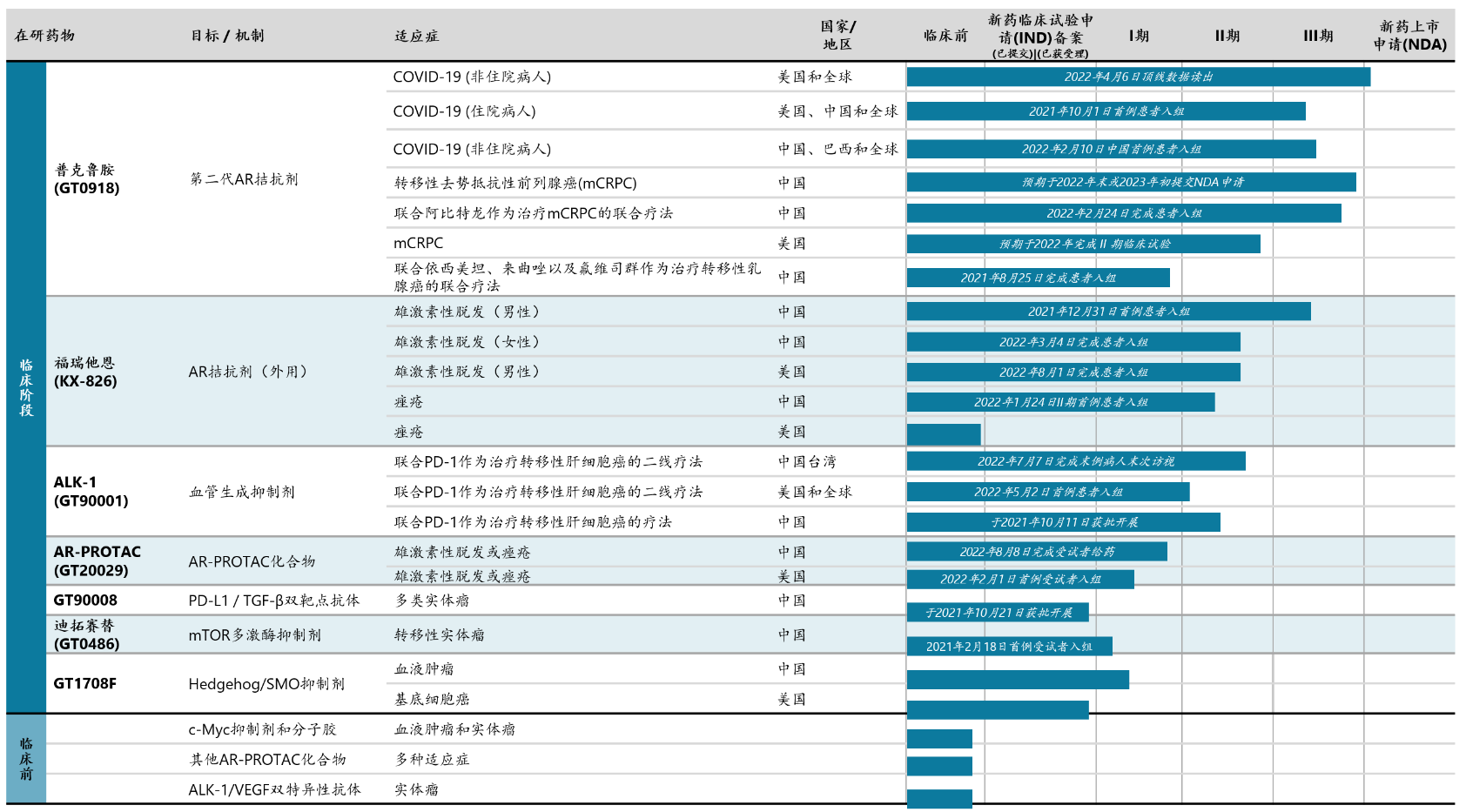
研发管线
指数纳入再下一城
2022年5月13日,开拓药业获纳入MSCI中国指数。MSCI系列指数是由摩根士丹利所编制的证券指数,是全球影响力最大的股票指数之一,也是国际投资者使用最多的基准指数之一。
公司股票此前已获纳入恒生综合指数、港股通以及富时罗素全球股票指数系列。
公司其他动态
·2022年1月11日,开拓药业荣获“最具价值医药及医疗公司” 奖项。
·2022年1月17日,开拓药业荣获上市公司企业号“投关先锋奖”。
·2022年4月8日,开拓药业于美国癌症研究协会(AACR)年会上,通过壁报(E-Poster)的方式公布普克鲁胺治疗新冠的作用机制和c-Myc degrader临床前研究数据。
·2022年5月26日,开拓药业宣布经广东省人力资源和社会保障厅批准,公司获批设立广东省博士工作站。
·2022年6月14日,开拓药业宣布公司与印度尼西亚Etana公司的临床及商业化合作作为“抗新冠药物的临床试验合作研发及海外应用示范”项目成功当选“一带一路”创新合作项目,被列入2022年度江苏省科技计划专项资金(创新支撑计划国际科技合作/港澳台科技合作)拟立项目清单。
·2022年8月4日,开拓药业获评“2022中国生物医药产业价值榜——最具影响力小分子创新药企业TOP20”。
·2022年8月,开拓药业首席技术官陆群博士获评“2022年姑苏创新创业领军人才”。
2022年中期财务业绩
截至2022年6月30日止六个月,公司的研发成本共计人民币约4.6亿元,同比增长约63.4%。研发成本主要是由于普克鲁胺新冠临床试验费用的增加以及研发的材料和耗材费用等增加。
截至2022年6月30日,公司在手现金、可变现金融资产和关联方借款合计为5.1亿元。截至2022年6月30日,公司未动用的银行授信额度为1.2亿元。
版权所有:Kintor Pharmaceutical Limited保留所有版权。苏ICP备19028699号-2 苏公网安备32059002001717号 Powered by 300.cn
投诉建议电话:0512-62639935 邮箱:public@kintor.com.cn






