新闻中心
新闻中心
开拓药业mTOR抑制剂获中国临床试验许可
开拓药业mTOR抑制剂获中国临床试验许可
【概要描述】[2019年8月20日,苏州] 苏州开拓药业股份有限公司(“开拓药业”)mTOR抑制剂“迪拓赛替片”正式获得国家药监局药品临床试验通知书,同意批准开展临床试验。
- 分类:公司新闻
- 作者:
- 来源:
- 发布时间:2019-08-20 14:30
- 访问量:
详情
[2019年8月20日,苏州] 苏州开拓药业股份有限公司(“开拓药业”)mTOR抑制剂“迪拓赛替片”正式获得国家药监局药品临床试验通知书,同意批准开展临床试验。 迪拓赛替片为新型mTORC1/mTORC2抑制剂(第二代mTOR抑制剂),适应症为晚期实体肿瘤。目前,在全球范围内尚未有第二代mTOR抑制剂上市,该领域的研究有着巨大的未被满足的临床需求。
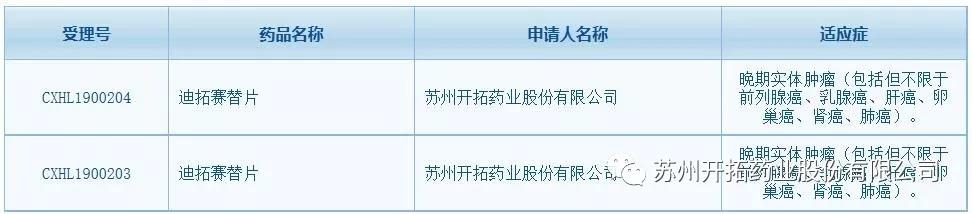
CDE网站迪拓赛替片受理信息查询
PI3K/AKT/mTOR信号通路参与细胞增殖、分化、凋亡和营养等多种细胞功能的调节,是肿瘤细胞中最常见的被激活的致癌信号通路,并在临床上被证明是多种癌症产生耐药性或转移的重要机制。 近年来以选择性抑制mTOR激酶为靶点的肿瘤治疗已经成为药物研究领域的热点。已上市的mTOR抑制剂,例如西罗莫司、替西罗莫司和依维莫司等,都属于雷帕霉素的衍生物,均为第一代mTOR抑制剂,即只能特异性抑制mTORC1,对mTORC2不敏感。近年来,陆续有新一代mTORC1/mTORC2双激酶抑制剂进入临床研发阶段,如武田的MLN0128(INK-128/TAK-228/Sapanisertib)、阿斯利康的AZD-8055和AZD-2014、新基公司的CC-223(即德琪医药的ATG-008)、山东罗欣药业的SCC-31(LXI-15029)以及徐诺药业的XP105(原代号BI-860585)等。因此,安全有效的新一代mTOR抑制剂作为first in class的创新药物是不少新药研发公司的追求目标,未来可以用于许多实体肿瘤的单药和联合用药的治疗,以满足日增的临床需求。
开拓药业获批mTOR抑制剂临床试验许可,意味着迪拓赛替作为公司自主研发并具全球专利的第二代mTOR选择性激酶小分子抑制剂,正式从临床前研发进入到临床发展阶段,也意味着开拓药业的创新药临床管线的进一步扩增。
关于开拓药业
开拓药业成立于2009年3月,专注发展“best-in-class”和“first-in-class”创新药物研发及产业化平台。公司所有产品均为1类新药,涉及前列腺癌、乳腺癌、肝癌和脱发等疾病领域,在全球拥有50余项专利,多个项目被列为国家十二五、十三五“重大新药创制”专项。公司的主要产品普克鲁胺在中、美同步开展临床试验,其针对mCRPC的二线疗法及一线疗法在中国处于III期临床阶段,在美国处于II期临床试验阶段,针对转移性乳腺癌已在中国完成I/Ib期临床试验,针对HR+/AR+/HER2-乳腺癌的联合用药研究处于Ic期临床试验阶段;治疗雄激素性秃发的福瑞他恩在中国和美国已完成I期临床试验、即将开展中国II期临床试验;ALK-1单抗为辉瑞首个授权中国公司的肿瘤抗体新药全球开发权利项目,已在美国等地完成100多个受试者的两个I期临床试验,目前正在台湾开展与PD-1(Nivolumab)联合治疗肝癌的II期临床试验。公司的研发管线还包括Hedgehog/SMO抑制剂、cMyc抑制剂和AR-Degrader等。开拓药业于2018年分别入选苏州市和苏州工业园区 “独角兽培育企业”。
版权所有:Kintor Pharmaceutical Limited保留所有版权。苏ICP备19028699号-2 苏公网安备32059002001717号 Powered by 300.cn
投诉建议电话:0512-62639935 邮箱:public@kintor.com.cn






